Démarche
Dans les codes de géochimie où les réactions chimiques sont écrites en lois d’action de masse (e.g. CHESS, PHREEQC…), les équilibres eau-gaz sont généralement traités en approche dissymétrique (i.e. activité-fugacité). Les lois d’action de masse de ces équilibres eau-gaz sont alors du genre :
![]()
![]()
avec
![]() la fraction molaire de CO2 dissous en solution,
la fraction molaire de CO2 dissous en solution,
![]() le coefficient d’activité du CO2 dissous en solution,
le coefficient d’activité du CO2 dissous en solution,
![]() la constante de Henry pour le CO2, fonction de la température et de la pression,
la constante de Henry pour le CO2, fonction de la température et de la pression,
![]() la fraction molaire du CO2 gazeux,
la fraction molaire du CO2 gazeux,
![]() le coefficient de fugacité du CO2 gaz.
le coefficient de fugacité du CO2 gaz.
Dans cette équation la constante de Henry à T et P est déterminée à partir de sa valeur tabulée à la pression de vapeur saturante :
![]()
avec
![]() le volume molaire partiel du CO2 dissous à la température T et moyenné sur l’intervalle de pression entre Psat et P.
le volume molaire partiel du CO2 dissous à la température T et moyenné sur l’intervalle de pression entre Psat et P.
Le calcul géochimique passe de fait par la résolution d’une équation d’état pour la phase gaz permettant le calcul du volume à pression fixée ou l’inverse. Dans le cas classique des équations d’état cubiques, le passage du volume à la pression est trivial et le passage de la pression au volume admet aussi une solution analytique via la méthode de Cardan par exemple [5,11].
L’équation d’état cubique de Peng-Robinson [7] est une des plus répandues, est déjà implémentée dans CHESS [12,3] et PHREEQC [6,1] et se présente comme suit :
![]()
avec
![]() la constante des gaz parfaits,
la constante des gaz parfaits,
![]() le volume molaire de la phase gaz et,
le volume molaire de la phase gaz et,
![]() et
et ![]() des paramètres propres à l’équation de Peng-Robinson.
des paramètres propres à l’équation de Peng-Robinson.
![]()
![]()
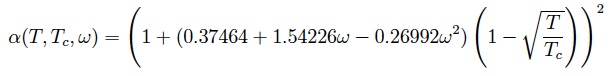
où
![]() la température critique,
la température critique,
![]() la pression critique et
la pression critique et
![]() le facteur acentrique du gaz.
le facteur acentrique du gaz.
Ces formules correspondent aux gaz purs, dans le cas d’un mélange de gaz, il convient d’utiliser une loi de mélange fonction de ces paramètres et des fractions molaires :
![]()
![]()
avec
![]() les paramètres d’interactions binaires propres, comme leurs noms l’indiquent, aux interactions entre les composés i et j en phase gaz et qui peuvent dépendre de la température.
les paramètres d’interactions binaires propres, comme leurs noms l’indiquent, aux interactions entre les composés i et j en phase gaz et qui peuvent dépendre de la température.
Pour la partie électrolytique, très importante pour les équilibres gaz-eau-sel mais non explicitée ici, les coefficients d’activité en solution sont calculés à partir de divers modèles d’activité. Dans le cas des solutions très salées (> 1 M), le modèle de Pitzer [8,9] utilisé dans PHREEQC et le modèle SIT [2,4] de CHESS permettent d’obtenir de bons résultats. Il est donc primordial d’avoir renseigné les paramètres d’interaction utilisés dans ces différents modèles.
En résumé, les paramètres nécessaires à la bonne représentation des gaz dans les codes de géochimie sont :
-
Des paramètres propres aux gaz purs (a priori assez bien connus et faciles à trouver)
- Température critique
- Pression critique
- Facteur acentrique
-
Des paramètres propres aux mélanges binaires de gaz (notamment avec H2O)
- Coefficient d’interaction binaire
-
Des paramètres propres à la solubilisation des gaz dans l’eau et les solutions aqueuses (e.g. NaCl...)
- Constante de Henry tabulée en fonction de la température et à pression de vapeur saturante
-
Volume molaire partiel moyen du gaz dissous sur l’intervalle de pression entre Psat et P
-
Paramètres d’interaction entre le gaz dissous et les différents ions en solution (suivant le modèle de correction d’activité utilisé, Pitzer ou SIT)
En prévision d’éventuelles évolutions des codes de calcul géochimique et/ou de progrès dans la façon de déterminer les propriétés thermodynamiques de formation des composés chimiques, d’autres paramètres pourraient s’avérer nécessaires. Il s’agit de :
- L’enthalpie de dilution d’une solution aqueuse en fonction de T et P,
- La capacité calorifique d’une solution aqueuse en fonction de T et P,
- La densité d’une solution aqueuse en fonction de T et P.
Pour réaliser ces calculs et alimenter ces modèles, il faut donc dans un premier temps collecter directement ces paramètres dans la littérature ou bien récupérer les données (i.e. données de solubilité eau-gaz, données d’équilibre liquide-vapeur des systèmes binaires...) permettant de les déterminer.
De plus, afin de valider la pertinence de la méthodologie de calcul décrite ci-dessus, les solubilités ainsi calculées seront comparées aux données expérimentales de solubilités.
Pour cette étape, les données suivantes seraient nécessaires :
- Solubilités des gaz dans la gamme de température et de pression de notre projet
- Solubilité des gaz purs et des mélanges binaires de gaz (en particulier CO2-Gaz annexes avec le CO2 majoritaire)
- Solubilité dans l’eau pure et dans les solutions salées avec différents types de sels (NaCl, CaCl2, CaCO3, Na2CO3, CaSO4...)